Kubán (vegyület)
| Kubán | |||
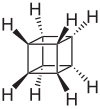 A kubán szerkezeti képlete |
 A kubán pálcikamodellje | ||
| Szabályos név | pentaciklo[4.2.0.02,5.03,8.04,7]oktán | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 277-10-1 | ||
| PubChem | 136090 | ||
| ChemSpider | 119867 | ||
| ChEBI | 33014 | ||
| |||
| |||
| InChIKey | TXWRERCHRDBNLG-UHFFFAOYSA-N | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C8H8 | ||
| Moláris tömeg | 104,15 g/mol | ||
| Sűrűség | 1,29 g/cm³ | ||
| Olvadáspont | 133,5 °C | ||
| Forráspont | 161,6 °C | ||
| Rokon vegyületek | |||
| Rokon szénhidrogének | kuneán dodekahedrán tetrahedrán prizmán prizmán C8 | ||
| Rokon vegyületek | heptanitrokubán oktanitrokubán oktaazakubán | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A kubán (C8H8) olyan szénhidrogén, melynek molekulájában nyolc szénatom egy kocka csúcsán helyezkedik el, és minden szénatomhoz egy hidrogénatom kapcsolódik. A legegyszerűbb oktaéderes szimmetriájú szénhidrogén. Szilárd, kristályos anyag, elsőként Philip Eaton és Thomas Cole szintetizálta 1964-ben.[3] Korábban úgy vélték, hogy a kocka alakú szénváz túl instabil ahhoz, hogy létezzen. A kocka alak miatt a szénatomok között szokatlanul kicsi, 90°-os a kötésszög, ami jelentős gyűrűfeszültséget okoz a tetraéderes koordinációjú szénatomban mért 109,45°-hoz képest. A kubánmolekula kinetikailag eléggé stabil, mivel nincs könnyen elérhető közvetlen bomlási módja.
A kinetikai stabilitás melletti nagy energiatartalom révén a kubán és származékai szabályozott energiatárolásra használhatóak. Az okta- és heptanitrokubánnak például vizsgálták a nagy energiájú robbanóanyagként történő alkalmazhatóságát.
E vegyületeknek a szokásos szénhidrogénekhez képest nagyon nagy a sűrűségük. Az ebből fakadó nagy energiasűrűség azt jelenti, hogy viszonylag nagy mennyiségű energiát lehet aránylag kis helyen tárolni, ami a tüzelőanyag tárolása és az energia szállítása során fontos szempont.
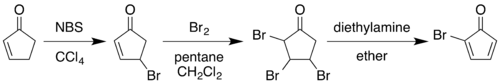
Előállítása[szerkesztés]
Az 1964-es klasszikus szintézis 2-ciklopenténon 2-brómciklopentadienonná történő átalakításával kezdődik:[3][4]
Szén-tetrakloridban N-brómszukcinimiddel végzett allil helyzetű brómozás, majd azt követő brómaddícióval az alkénből 2,3,4-tribrómciklopentanon keletkezik. Ezt dietil-éterben dietil-aminnal kezelve eliminációs reakcióban két hidrogén-bromid kilépése mellett dién jön létre.
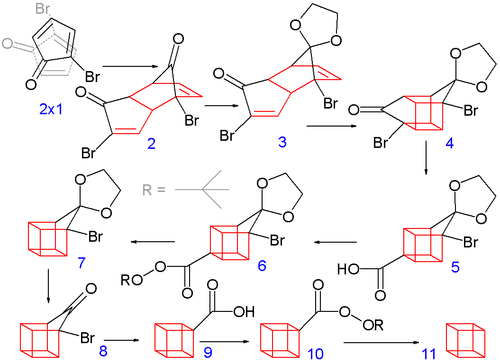
A nyolc szénatomos kubánváz felépítése a 2-brómciklopentadienon spontán Diels-Alder dimerizációjával kezdődik – ez a ciklopentadién diciklopentadiénné történő dimerizációjával analóg –, az 1 vegyület két molekulájának reakciójával a 2 vegyület keletkezik. A további lépések végbemeneteléhez csak az endo izomer alkalmas, ebben a reakcióban túlnyomó részt ez az izomer keletkezik.
Ez a termék a legvalószínűbb, mivel az egyik molekulán levő brómatom és a másik reaktánson levő karbonilcsoport közötti sztérikus kölcsönhatás így a legkisebb, miközben a két reaktáns megközelíti egymást, valamint a reakció átmeneti állapotában a hasonló dipólusok közötti kölcsönhatás is így a legkisebb. Mindkét karbonilcsoportot benzolban etilénglikollal és p-toluolszulfonsavval acetál formában védik, majd az egyik acetál védőcsoportot vizes sósavval szelektíven eltávolítva nyerik a 3 vegyületet.
A következő lépésben a 3 endo izomer (melyben mindkét alkén funkció egymáshoz közel található) fotokémiai [2+2] cikloaddíciós reakcióban kialakítja a ketrecszerű 4 szerkezetet. A brómketon csoportot kálium-hidroxiddal végzett Favorszkij-átrendeződéses gyűrűszűkítéssel 5 karbonsavvá alakítják, majd a következő lépésben – a (tionil-kloriddal képzett) savkloridon keresztül terc-butil-hidroperoxiddal és piridinnel képzett 6 terc-butil perészter – termikus dekarboxilezésével 7 keletkezik, majd még egy acetál eltávolításával 8 képződik. További Favorszkij-átrendeződéssel keletkezik a 9, és végül újabb dekarboxilezéssel a 10-en keresztül alakul ki a 11 kubán.
Származékai[szerkesztés]
Az oktafenil származékát tetrafenilciklobutadién-nikkel-bromidból kiindulva már 1962-ben, az alapvegyület szintézisét megelőzően előállította Freedman. Ez a származék kevéssé oldódó, színtelen anyag, olvadáspontja 425–427 °C.[2][5][6][7] } Egy 2014-es publikáció szerint a hiperkocka szerkezetű hiperkubán is létezhet.[8][9] A kubénnak két különböző izomerjét állították eddig elő, és egy harmadikat számítógépes módszerekkel vizsgáltak. Az orto-kubén alkén funkciója piramidalizációs geometriája miatt rendkívül reakcióképes. Előállításakor ez volt a legnagyobb piramidalizációjú, sikeresen előállított alkén.[10] A meta-kubén izomer még kevésbé stabil, a para-kubén pedig valószínűleg csak kettős gyök formájában létezik, semmint hogy benne a testátló mentén valódi kötés legyen.[11]
Reakciói[szerkesztés]
Fémionok által katalizált σ-kötés-átrendeződéssel kuneán állítható elő.[12][13]
Hivatkozások[szerkesztés]
- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry, 169. o.. DOI: 10.1039/9781849733069-FP001 (2014. április 25.). ISBN 978-0-85404-182-4 „The retained names adamantane and cubane are used in general nomenclature and as preferred IUPAC names.”
- ↑ a b c (2015) „Cubane: 50 years later”. Chemical Reviews 115, 6719–6745. o. DOI:10.1021/cr500523x. PMID 26102302.
- ↑ a b (1964. április 25.) „Cubane”. J. Am. Chem. Soc. 86 (15), 3157–3158. o.
- ↑ (1964. április 25.) „The Cubane System”. J. Am. Chem. Soc. 86 (5), 962–964. o.
- ↑ Freedman, H. H. (1961. április 25.). „Tetraphenylcyclobutadiene Derivatives. II.1 Chemical Evidence for the Triplet State”. J. Am. Chem. Soc. 83 (9), 2195–2196. o.
- ↑ Freedman, H. H. (1962. április 25.). „Tetraphenylcyclobutadiene Derivatives. IV.1 "Octaphenylcubane"; A Dimer of Tetraphenylcyclobutadiene”. J. Am. Chem. Soc. 84 (14), 2837–2838. o.
- ↑ (1964. április 25.) „Structure of the Dimer of tetraphenylcyclobutadiene”. J. Am. Chem. Soc. 86 (21), 4725–4726. o.
- ↑ Pichierri, F. (2014. április 25.). „Hypercubane: DFT-based prediction of an Oh-symmetric double-shell hydrocarbon”. Chem. Phys. Lett. 612, 198–202. o. DOI:10.1016/j.cplett.2014.08.032.
- ↑ http://www.compchemhighlights.org/2014/12/hypercubane-dft-based-prediction-of-oh.html
- ↑ (1988) „Cubene (1,2-dehydrocubane)”. J. Am. Chem. Soc. 110 (21), 7230–7232. o. DOI:10.1021/ja00229a057.
- ↑ 2.3 A Theoretical Approach to the Study and Design of Prismane Systems, Strained Hydrocarbons. Wiley, 55. o. (2009). ISBN 9783527627141
- ↑ March’s Advanced Organic Chemistry, 5th, John Wiley & Sons, 1459. o. (2001. április 25.)
- ↑ (1966. április 25.) „Studien über den Mechanismus chemischer Reaktionen, XXIII. Hydrierungen von Nitrilen unter Verwendung von Terpenen als Wasserstoffdonatoren”. Chem. Ber. 99, 227–232. o.
Fordítás[szerkesztés]
Ez a szócikk részben vagy egészben a Cubane című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További olvasnivalók[szerkesztés]
- Eaton's cubane synthesis at SynArchive.com
- Tsanaktsidis's cubane synthesis at SynArchive.com
- Cubane chemistry at Imperial College London