User:Kaden.Rawson/sandbox
This sandbox will be used for the following purposes:[edit]
Facilitate collaboration pertaining to the addition of "Kinesin regulation" to the article "Kinesin" for UofU Molecular Motors Spring 2019[edit]
Materials to read and gather information from:[edit]
Auto inhibition:[edit]
- Dr. Vershinin recommends working on auto inhibition because it is the least disputed means of regulation.
***"The Structure of the Kinesin-1 Motor-Tail Complex Reveals the Mechanism of Autoinhibition" Hung Yi Kristal Kaan, David D. Hackney, Frank Kozielski
Cell, Volume 56, Issue 5, 867-878 (1989)
J Biol Chem, vol. 274, no. 21, 14617–14623 (1999)
Nature Reviews Molecular Cell Biology 1, 50-58 (2000)
***Nature Reviews Molecular Cell Biology 10, 765-777 (2009)
J Cell Biol. 176(1): 11–17 (2007)
Auto-Inhibition GIF

Изображение передвижной формы и само-ингибирования. Передвижная форма: двигательные домены кинезина-1 (желтый и оранжевый) могут свободно двигаться вдоль микротрубочки при отсутствии области IAK тяжелой цепи в спиральной катушке хвостового домена (зеленый). Само-ингибирование: IAK область хвоствого домена (зеленый) образовывает связь к двигательным доменам (желтый и оранжевый), чтобы препятствовать ферментативному циклу для передвижения и формированию крепительных связей к микротрубочкам.
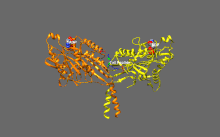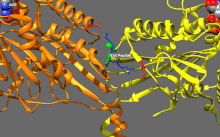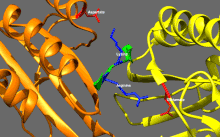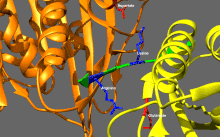
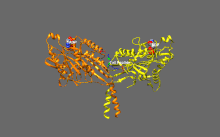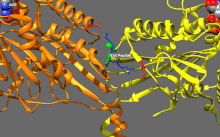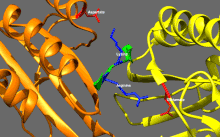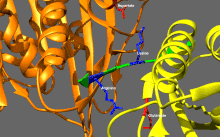

Facilitate creation of "Kinesin binding to microtubules" to the article "Kinesin" for UofU Molecular Motors Spring 2019[edit]
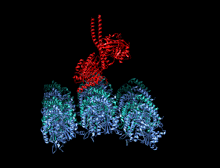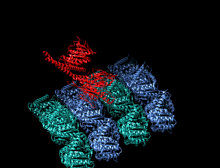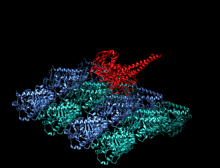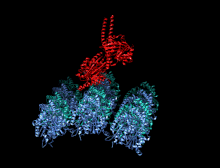
Facilitate translation of "Kinesin regulation" and "Kinesin binding to microtubules" to the Russian language for the article "Кинезин"[edit]
Передвижная форма: двигательные домены кинезина-1 (желтый и оранжевый) могут свободно двигаться вдоль микротрубочки при отсутствии положительно заряженных аминокислотных остаток в области IAK (синие) тяжелой цепи в спиральной катушке хвостового домена (зеленый).
Само-ингибирование: положительно заряженные аминокислотные остатки в области IAK (синие) тяжелой цепи в спиральной катушке хвостового домена (зеленый) находятся между моторными доменами кинезина-1 и образовывают связь в двух местах с отрицательно заряженными аминокислотными остатками (красные) на обоих двигательных доменах, чтобы IAK область хвоста кинезина-1 препятствовала ферментативному циклу по передвижению и крепительной связи к микротрубочкам.[1]
положительно заряженные аминокислотные остатки в области IAK (синие) тяжелой цепи в спиральной катушке хвостового домена (зеленый) отсутствуют и поэтому двигательные домены кинезина-1 (желтый и оранжевый) могут свободно двигаться вдоль микротрубочки.
 | This is a user sandbox of Kaden.Rawson. You can use it for testing or practicing edits. This is not the sandbox where you should draft your assigned article for a dashboard.wikiedu.org course. To find the right sandbox for your assignment, visit your Dashboard course page and follow the Sandbox Draft link for your assigned article in the My Articles section. |
- ^ a b c d Kaan, Hung Ti (August 2011). "The Structure of the Kinesin-1 Motor-Tail Complex Reveals the Mechanism of Autoinhibition". Science. 333: 883–885.
- ^ Kaan, Hung Yi (August 2011). "The Structure of the Kinesin-1 Motor-Tail Complex Reveals the Mechanism of Autoinhibition". Science. 333: 883–885.
